欧亚经济联盟(EAEU)医疗器械注册
获得欧亚经济联盟(EAEU)注册证书
关键特点:
-
欧亚经济联盟(EAEU)注册证书(RC)可以扩展到EAEU成员国(俄罗斯联邦、亚美尼亚共和国、白俄罗斯共和国、哈萨克斯坦共和国、吉尔吉斯共和国),为医疗器械(MD)制造商和分销商提供更大的市场。
根据当前规定,申请人必须选择至少一个认可国以外的参考国。如果认可国的专家组织不同意参考国的专家意见,产品注册只在一个EAEU成员国(参考国)的领土上有效的情况是可能的。 -
根据EAEU规定获得的注册证书是无限期发放的。
-
EAEU注册对医疗器械(MD)及其注册资料夹文件提出了更严格的要求,从而提高了最终产品质量和对质量管理体系实施的更好控制。
根据EAEU规则进行MD注册的程序由欧亚经济委员会理事会2016年2月12日第46号决定《关于注册和检查医疗器械的安全性、质量和有效性的规则》进行规定。
医疗器械注册分为两个阶段:
第一阶段 – 资料夹准备:
- 根据注册规则和法规行为的要求编制、准备/调整资料夹文件。
在这个阶段,可以与专家组织进行初步咨询,讨论特定的注册和审查问题。
一旦确定了资料夹文件清单,就会根据欧亚经济委员会(EEC)理事会2016年2月12日第27号决定确认医疗器械(MD)及其文件与一般安全性和有效性要求的符合性。为此,组织适用于MD的测试范围:
- 技术测试(根据EEC理事会2016年2月12日第28号决定)。
- 评估MD生物效应的研究(根据EEC理事会2016年5月16日第38号决定)。
- 批准测量设备类型的测试(根据欧亚经济委员会理事会2016年10月18日第98号决定,2016年2月12日第42号决定)。
- 临床试验(EEC理事会2016年2月12日第29号决定)。
- MD研究(测试)的范围、持续时间和成本由它们的特点决定,取决于它们的类型(植入式或非植入式;主动、非主动;无菌、非无菌;一次性、可重复使用;体外诊断设备等)。
我们公司分析、调整和编写医疗器械的文件,确定所需的测试范围,选择最佳的测试中心进行测试,并选择所需样品和测试文件的清单。因此,我们管理并陪同整个测试过程:从申请测试中心到接收测试协议。
第二阶段 – 医疗器械的注册和专家评估:
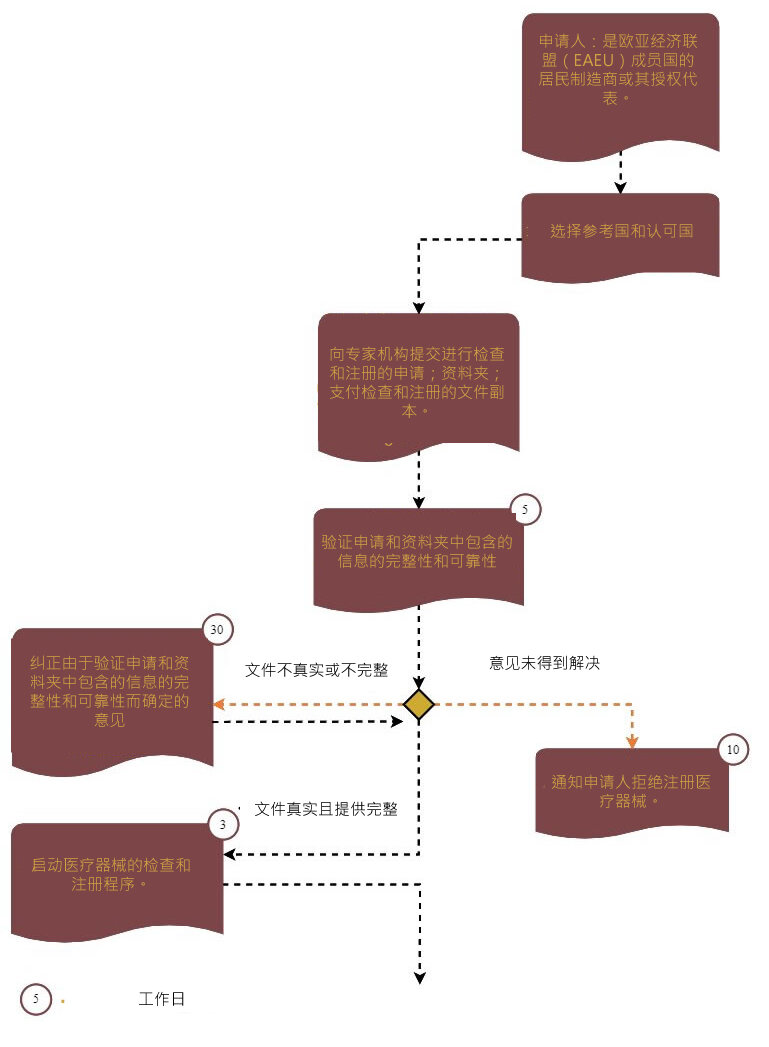
文件准备阶段之后,开始进行专家评估和注册程序。
第一步涉及检查申请人提交的文件的完整性和准确性。
医疗器械在俄罗斯联邦的注册由联邦医疗保健监督服务机构(Roszdravnadzor,RZN)负责。在提供国家注册服务的过程中,RZN将资料夹发送到下属机构之一进行质量、安全性和有效性的专家评估。
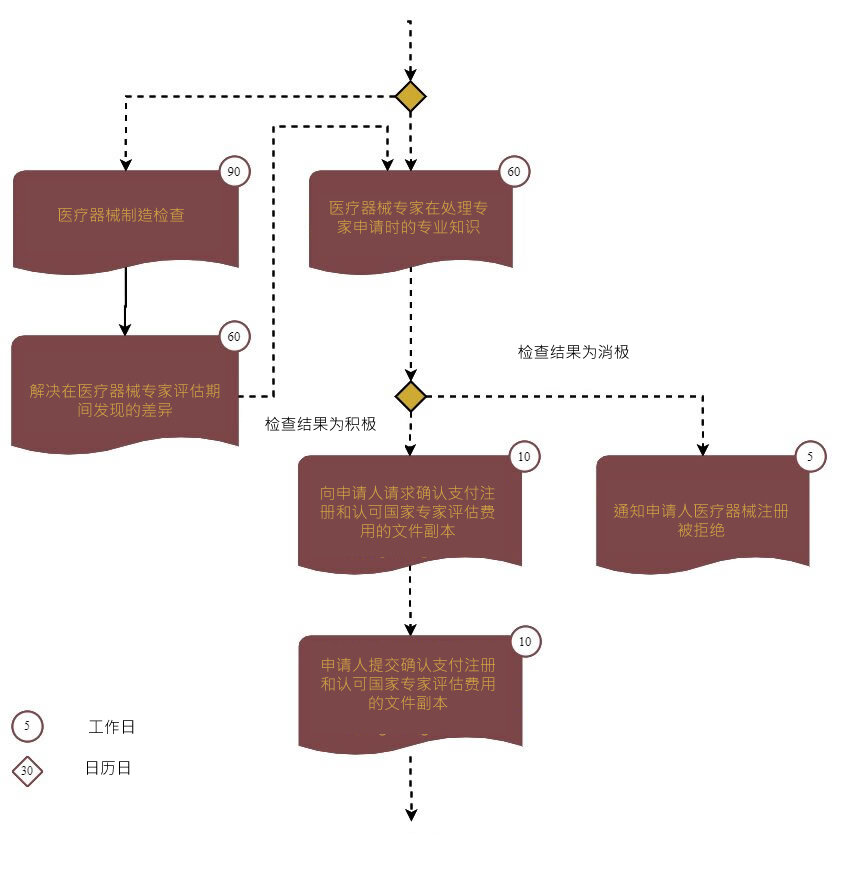
第二阶段分为三个步骤:
步骤1:提交文件
步骤2:进行医疗器械的检查。
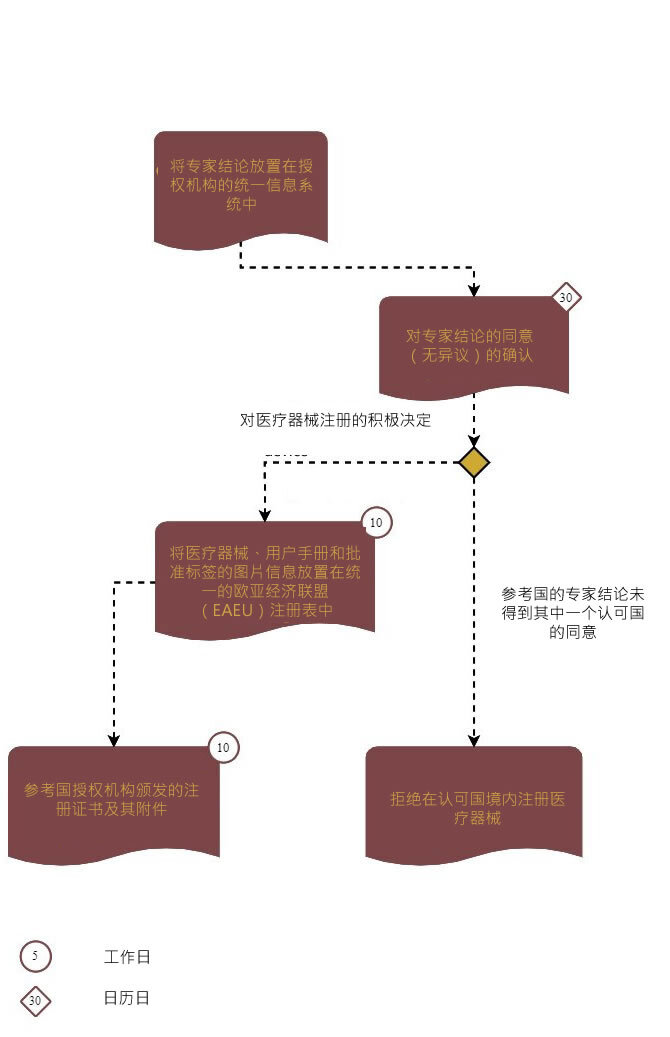
步骤3:从认可国接收专家结论的批准
授权机构(特殊机构)发出合理拒绝注册医疗器械的理由:
a) 提交的材料和注册资料夹中包含的数据、医疗器械的质量、效率和安全性不符合要求;
b) 使用该设备的风险超过医疗实践中潜在的健康益处;
c) 缺乏所需的临床试验数据来支持所声称的性能和使用效果;
在获得积极结果后,联邦服务机构将发放注册证书及其附件。
我们在整个考虑阶段管理项目,提供资料夹准备、处理意见以及准备对专家服务询问的合理回应的专业协助。
请向我们发送请求,我们的注册专家将分析您拥有的数据,选择最佳注册算法,评估准备资料夹所需的工作量,并向您发送资料夹准备服务的商业提案。
咨询请求
为了评估注册医疗器械的费用,请填写这份简短的问卷,以获得我们服务的10%折扣。